Диэтиленгликоль
Содержание:
- Применение этиленгликоля
- Примеры решения задач
- Молярная масса элементов и соединений
- Применение гликоля в разных областях техники
- Экологические последствия
- Физические и химические свойства гликолей
- Меры безопасности
- Химические реакции
- Подробнее о Этан-1,2-диол
- Физические свойства водного раствора этиленгликоля
- Химические реакции
- Характеристика общих химических свойств
- Применение [ править | править код ]
- Хранение этиленгликоля
- Неотложная помощь при остром отравлении этиленгликолем
- Токсичность
- Экологические последствия
- Некоторые нюансы производства гликоля
- Цены на растворы этиленгликоля оптом
- Сфера применения
- Этиленгликоль – токсичный двухатомный спирт
- Расчет молярной массы
- Что такое этиленгликоль
Применение этиленгликоля
Этиленгликоль широко применяется в химической и фармацевтической, в текстильной и электротехнической, в автомобильной и авиационной промышленностях.
Водный раствор этиленгликоля при одной и той же концентрации имеет более низкую температуру кристаллизации (замерзания) по сравнению с водными растворами на основе пропиленгликоля. Также раствор этиленгликоля по сравнению с растворами пропиленгликоля имеет более низкую вязкость, что существенно снижает потери при циркуляции раствора этиленгликоля в системе отопления (охлаждения, кондиционирования). Раствор этиленгликоля обладает и более высокими значеними теплоемкости и теплопроводности, поэтому ему и отдается предпочтение как теплоносителю (антифризу,хладагенту) в закрытых инженерных системах.
Нелинейный характер зависимости температуры кристаллизации водного раствора этиленгликоля
от его концентрации представлены в табл. №1 в виде двух функциональных зависимостей: 1) значения величины плотностиводного раствора в зависимости от его концентрации при температуре 20°C и 2) зависимость температуры кристаллизации водного раствора от концентрациии этиленгликоля.
Табл. №1. Влияние концентрации этиленгликоля на температуру кристаллизацию водного раствора этиленгликоля. Значения (величины) плотности раствора при температуре 20°C.
| Концентрация этиленгликоля, % | Температура замерзания, °C | Плотность при 20 °C |
| 30% | -15 °C | 1,038 |
| 35% | -20 °C | 1,045 |
| 40% | -25 °C | 1,052 |
| 45% | -30 °C | 1,058 |
| 50% | -35 °C | 1,064 |
| 54% | -40 °C | 1,071 |
| 60% | -50 °C | 1,077 |
| 65% | -65 °C | 1,083 |
| 70% | -60 °C | 1,088 |
Примеры решения задач
| Задание | В результате присоединения йода к этилену получено 98,7 г иодопроизводного. Рассчитайте массу и количество вещества этилена, взятого для реакции. |
| Решение | Запишем уравнение реакции присоединения йода к этилену: |
В результате реакции образовалось иодопроизводное – дийодэтан. Рассчитаем его количество вещества (молярная масса равна – 282 г/моль):
Согласно уравнению реакции n(C2H4I2) : n(C2H4) = 1:1, т.е. n(C2H4I2) = n(C2H4) = 0,35 моль. Тогда масса этилена будет равна (молярная масса – 28 г/моль):
Ответ
Масса этилена равна 9,8 г, количество вещества этилена равно 0,35 моль.
| Задание | Рассчитайте объем этилена, приведенный к нормальным условиям, который можно получить из технического этилового спирта C2H5OH массой 300 г. Учтите, что технический спирт содержит примеси, массовая доля которых равна 8%. |
| Решение | Запишем уравнение реакции получения этилена из этилового спирта: |
Найдем массу чистого (без примесей) этилового спирта. Для этого сначала рассчитаем его массовую долю:
Определим количество вещества этилового спирта (молярная масса – 46 г/моль):
Согласноуравнениюреакцииn(C2H5OH) : n(C2H4) = 1:1, т.е. n(C2H5OH) = n(C2H4) = 3,83 моль. Тогда объем этилена будет равен:
Так, я могу лишь частично помочь, ибо химия была давненьковариант 1.задание 2.углерод-этанвыделяют фракционной перегонкой нефти, природного газа или смесей углеводородов. Реакция гидрирования.
2 C + (2+1) H2 —-при температуре 400 градусов, под давлением- C2H6
этан-этендегидрирование этана C2H6 — C2H4 + H2
этен-этанолреакция гидротацииC2H4 + H2О —платиновый катализатор, при нагревании(t)- C2H5ОH + H2
этанол-этаналь(=ацетальдегид)окисление спирта C2H5ОH + CuO —t(при нагревании) при реакции уходит вода, медь-> CH3СОH
этаналь-этановая кислота(=уксусная кислота)реакция медного зеркалаCH3СОH + 2CuO —под нагреванием, при реакции уходит вода-> CH3СООH + 2CuOH(который распадается на Cu2O, воду)
этановая кислота-метилэтанатвот если честно не очень помню(не ручаюсь за правильность этой реакции) CH3СООH + CH3ОH — 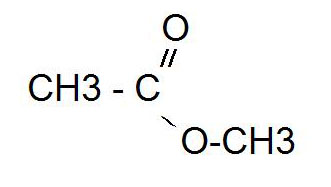
так теперь вариант 1 изомерияCH3-CH2-CH2-CH2-CH2(OH) — пентанол 1CH3-CH2-CH2-CH(OH)-CH3 — пентанол-2CH3-CH2-CH(OH)-CH2-CH3 — пентанол-3СН3—СН(СН3)—СН2—СН2ОН — 3-метилбутанол — 1СН3—СН2—СН(СН3)—СН2ОН — 2 метилбутанол — 1 2,2-диметилпропанол -1
2-метилбутанол-2 3 -метилбутанол-2
вода, этанол, глицеринэтанол, можно привести реакцию с хромовой смесью, в результате взаимодействия этилового спирта и хромовой смеси(а также серной кислоты) образуется раствор ярко-зеленого цвета с запахом яблок(запах яблок имеет образующийся в ходе реакции ацетальдегид, а цвет придает сульфат меди — Cr2(SO4)3 )3C2H5ОH + K2Cr2O7 —-H2SO4-> 3CH3СОH + K2SO4 + Cr2(SO4)3 + 7H2O
глицеринэто многоатомный спирт, качественной реакцией на них является реакция со свежеприготовленным оксидом меди(2). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II).извините, реакцию писать долго и нудно, и к томуже очень трудно в условиях дайра
по логике выясняем что третья пробирка с водой
4 задание в обоих вариантах не решаю, ибо не дружу с задачами
вариант 2задание 2углерод-этилен(этен)2 C + 2 H2 —-при температуре 400 градусов, под давлением- C2H4
этилен-этиловый спиртгидротацияC2H4 + H2О —платиновый катализатор, при нагревании(t)- C2H5ОH + H2
этанол-этаналь(=ацетальдегид=уксусный альдегид)окисление спирта C2H5ОH + CuO —t(при нагревании) при реакции уходит вода, медь-> CH3СОH
уксусный альдегид — этилацетатреакция этерефикацииCH3СОH + C2H5ОH -температура, серная кислота СН3-СОО-CH2-CH3
гидратация: C2H4 + H2O —> C2H5OH
окисление при помощи, например, оксида меди (II) C2H5OH + CuO —> CH3CHO + Cu + H2O
реакция «серебряного зеркала» CH3CHO + аммиачный раствор Ag2O —> CH3COOH + 2Ag
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Применение гликоля в разных областях техники
Малая себестоимость данного многоатомного спирта, его особые химические и физические свойства (плотность и другие) привели к тому, что он используется весьма широко в различных технических сферах.
Любой автомобилист знает, что представляет собой обычная охлаждающая жидкость для его «железного коня» под названием антифриз – этиленгликоля 60 % + воды 40 %. Такая смесь характеризуется температурой замерзания -45 градусов, очень трудно найти более подходящую жидкость для автомобильных систем охлаждения, несмотря даже и на высокий класс опасности 1,2-этандиола.
В автомобильной отрасли этиленгликоль находит применение и в качестве отличного теплоносителя. Кроме того, он используется в следующих сферах:
- органический синтез: химические свойства гликоля позволяют с его помощью защищать изофорон и другие карбонильные группы, использовать спирт в виде эффективного растворителя, работающего при повышенных температурах, а также в качестве основной составляющей специальной авиационной жидкости, уменьшающей явление обводнения горючих смесей для летательных аппаратов;
- растворение красящих соединений;
- изготовление нитрогликоля – мощного взрывчатого вещества на основе описываемого нами соединения;
- газодобывающая промышленность: гликоль не позволяет формироваться гидрату метана на трубах, кроме того, он поглощает излишнюю влагу на трубопроводах.
Экологические последствия
Этиленгликоль — это крупносерийная химия; он распадается на воздухе примерно через 10 дней, а в воде или почве — через несколько недель. Он попадает в окружающую среду за счет рассеивания продуктов, содержащих этиленгликоль, особенно в аэропортах, где он используется в противообледенительный агенты для взлетно-посадочных полос и самолетов. В то время как пролонгированные низкие дозы этиленгликоля не проявляют токсичности, в дозах, близких к летальным (≥ 1000 мг / кг в день), этиленгликоль действует как тератоген. «Основываясь на довольно обширной базе данных, он вызывает изменения скелета и пороки развития у крыс и мышей при всех путях воздействия». Эта молекула наблюдалась в космосе.
Физические и химические свойства гликолей
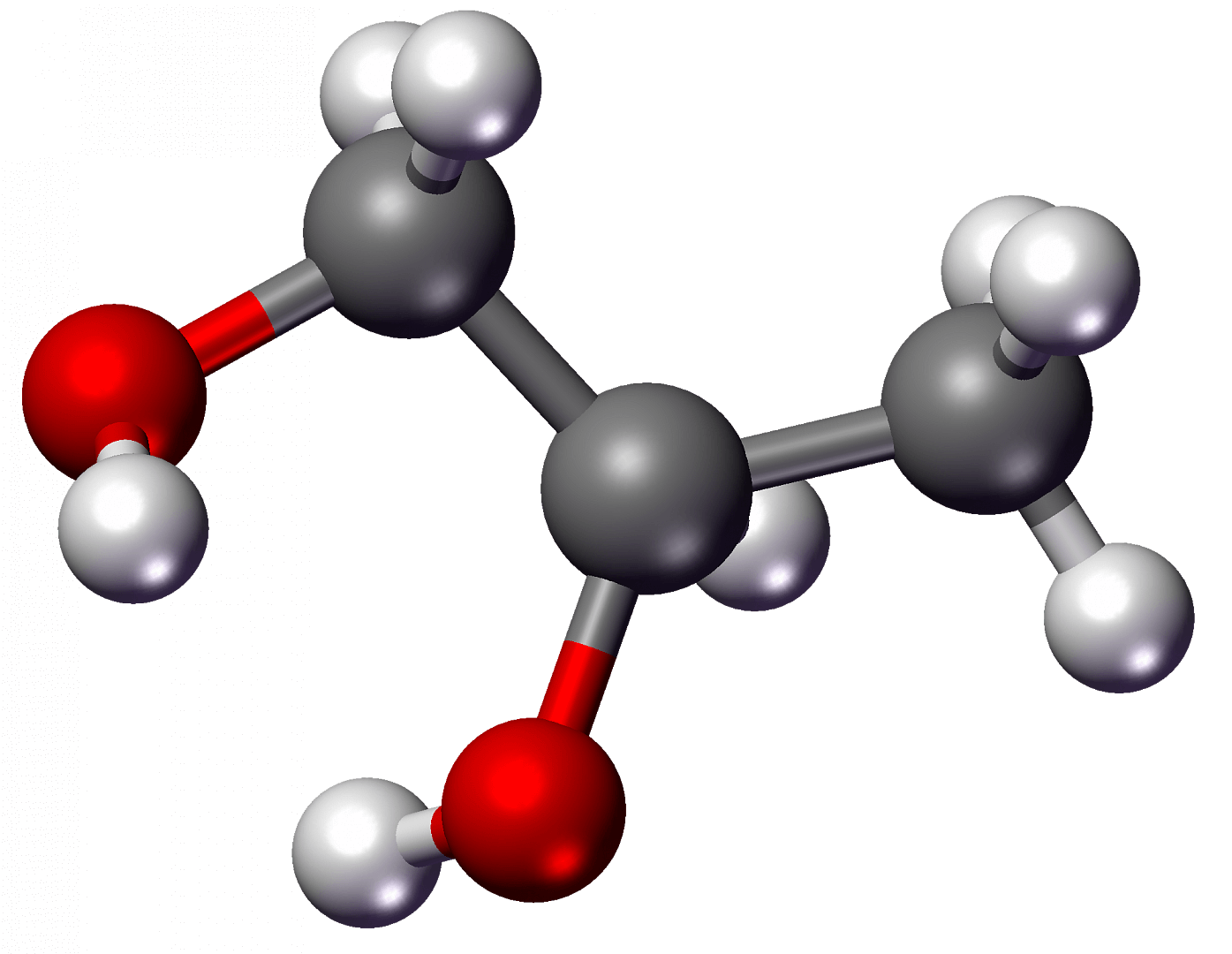 Низшие двухатомные спирты (этиленгликоль и пропиленгликоль) – это бесцветные прозрачные жидкости. Наличие полярных гидроксильных групп влияет на физические характеристики вещества – высокую плотность, вязкость и теплопроводность.
Низшие двухатомные спирты (этиленгликоль и пропиленгликоль) – это бесцветные прозрачные жидкости. Наличие полярных гидроксильных групп влияет на физические характеристики вещества – высокую плотность, вязкость и теплопроводность.
Пропилен- и этиленгликоль хорошо растворяются в воде и органических растворителях – карбоновых кислотах, кетонах, аминах, спиртах. Низшие гликоли используются в качестве растворителей для большинства органических соединений кроме высших предельных и ароматических углеводородов.
Химические свойства диолов схожи с одноатомными спиртами. При взаимодействии с металлами и их солями образуют алкоголяты, при соединении с кислотами – простые и сложные эфиры. Каждая полярная гидроксильная группа вступает в химическую реакцию независимо друг от друга, что приводит к образованию смеси продуктов.
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
Химические реакции
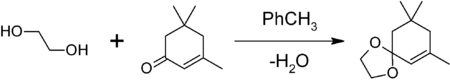
Этиленгликоль используется как защитная группа для карбонильные группы в органический синтез. Обработка кетона или альдегида этиленгликолем в присутствии кислотного катализатора (например, п-толуолсульфоновая кислота; BF3· Et2О) дает соответствующую 1,3-диоксолан, который устойчив к основаниям и другим нуклеофилам. После этого защитную группу 1,3-диоксолана можно удалить дополнительной кислотой. гидролиз. В этом примере изофорон был защищен этиленгликолем п-толуолсульфоновой кислотой с умеренным выходом. Вода была удалена азеотропная дистилляция сдвинуть равновесие вправо.
Подробнее о Этан-1,2-диол
Информационная карта «Этан-1,2-диол» —13.06.2019 была частично изменена в поисковой базе.
Регистрационый номер:
ВТ-000123
Химическое название вещества по IUPAC:
Этан-1,2-диол
Наименование технического продукта CAS:
Структурная формула:
C2H6O2
Синонимы:
1,2-Дигидроксиэтан; гликоль; этилен дигидрат; 2-гидроксиэтанол; Ethylene glycol; 1,2-Ethanediol; ethane-1,2-diol
Торговые названия:
Этиленгликоль; моноэтиленгликоль НКНХ; этиленгликоль (водный раствор); жидкости охлаждающие низкозамерзающие (марок Тосол-А-40М Антифриз Сoolant, Антифриз для отопления); Арал Антифриз Безсиликатный/Aral Antifreeze Silikatfrei; Ethylen Glyc
Регистрационные номера:
Роспотребнадзор:
РПОХВ:
ВТ-000123
CAS:
107-21-1
RTECS:
KW2975000
EC:
203-473-3
Дата регистрации:
26.10.1994 г.
Дата актуализации:
28.11.2016 г.
ОБЛАСТЬ ПРИМЕНЕНИЯ:
Химическая, текстильная, автомобильная, авиационная, электрохимическая, нефтехимическая, фармацевтическая промышленность. Лабораторное дело
АГРЕГАТНОЕ СОСТОЯНИЕ:
жидкое
Форма выпуска:
Жидкость
Средства индивидуальной защиты:
респиратор;защитные очки;перчатки;другое
Меры при разливе и рассыпании:
Собрать в емкость и передать на утилизацию
Утилизация:
Сжигание
Кумулятивность:
слабая
Метод Lim et al., 1/10DL50, в/ж, крысы. Ccum = 8,3. 1/5DL50, в/ж, 20 дней, крысы — отсутствие гибели животных.
Клиническая картина острого отравления:
Обладает наркотическим действием. Кратковременное возбуждение, сменяющееся угнетением, чувство опьянения, нарушение координации движения, вялость, головная боль, головокружение, рвота, боли в области живота, диарея, повышение температуры тела, одышка, тахикардия; в тяжелых случаях — клонико-тонические судороги, потеря сознания
Центральная нервная, сердечно-сосудистая и дыхательная системы, почки, печень, желудочно-кишечный тракт, морфологический состав периферической крови
Раздражающее действие:
На кожу:
да.На глаза:
да.
Кожно-резорбтивное действие:
да
Первая помощь при отравлениях:
При вдыхании — свежий воздух, покой, тепло; крепкий чай или кофе. При попадании через рот — прополоскать ротовую полость водой, обильное питье воды, активированный уголь,солевое слабительное; внутрь — 30% р-р этилового спирта по 30 мл через каждые 3 ч. При попадании на кожу — удалить избыток вещества ватным тампоном, смыть проточной водой с мылом. При попадании в глаза — промыть проточной водой при широко раскрытой глазной щели в течение 15 мин. Во всех случаях при необходимости срочно обратиться за медицинской помощью.
Гигиенические нормативы:
| ОБУВ (атмосферный воздух) | |
| м.р. | 1 мг/м куб |
| с.с. | мг/м куб |
| Класс опасности | |
| ПДК (раб.зона) | |
| м.р. | 10 мг/м куб |
| с.с. | 5 мг/м куб |
| Класс опасности | 3 |
| ДУ (пищевые продукты) | |
| ПДК (водные объекты) | |
| 1 мг/л | |
| с.-т. | |
| Класс опасности | 3 |
| Питьевая вода | |
| мг/л | |
| Класс опасности | |
| Вода питьевая, расфасованная в емкости | |
| Первая категория | |
| Высшая категория | |
| Класс опасности | |
| ПДК (почва) | |
| мг/кг | |
| Вещество | |
| а) песчаные и супесчаные | |
| б) кислые (суглинистые и глинистые), pH KCL | |
| в) близкие к нейтральным, нейтральные (суглинистые и глинистые), pH KCL > 5,5 | |
| ПДУ (кожа) | |
| Класс опасности | |
| Примечание | п + а — смесь паров и аэрозоля; |
Метод определения:
Раб.з. — газохроматографический, 2,5 мг/м3. Методические указания по измерению концентрации вредных веществ в воздухе рабочей зоны.-М., 1986.-Вып.XXI.-N3999-85.-С.317.
Физические свойства водного раствора этиленгликоля
В таблице представлены следующие теплофизические и физические свойства этиленгликоля в виде водного раствора различной концентрации ζ: плотность ρ, температура замерзания tз, теплоемкость C, динамическая вязкость μ, кинематическая вязкость ν, теплопроводность λ, температуропроводность a, число Прандтля Pr этиленгликоля. Физические свойства раствора этиленгликоля приведены в таблице в зависимости от температуры и его концентрации в растворе.
По данным таблицы видно, что с увеличением концентрации этиленгликоля в растворе его теплоемкость и теплопроводность уменьшаются, а температура замерзания раствора снижается при концентрации этиленгликоля до 66,3%. При дальнейшем увеличении концентрации этиленгликоля, температура замерзания раствора начинает повышаться.
В случаях применения раствора этиленгликоля в качестве антифриза в системе охлаждения автомобиля, снижение величин этих физических свойств этиленгликоля приведет к меньшему теплоотводу от двигателя. Таким образом, чем более концентрированный раствор этиленгликоля применяется в качестве охлаждающей жидкости, тем менее эффективно будет работать система охлаждения автомобиля в части отвода тепла от двигателя.
Физические свойства этиленгликоля даны в диапазоне температуры от минус 30 до 50°С и при концентрации этиленгликоля в растворе от 4,6 до 46,4 %.
Химические реакции
Этиленгликоль используется как защитная группа для карбонильные группы в органический синтез. Обработка кетона или альдегида этиленгликолем в присутствии кислотного катализатора (например, п-толуолсульфоновая кислота; BF3· Et2О) дает соответствующую 1,3-диоксолан, который устойчив к основаниям и другим нуклеофилам. После этого защитную группу 1,3-диоксолана можно удалить дополнительной кислотой. гидролиз. В этом примере изофорон был защищен этиленгликолем п-толуолсульфоновой кислотой с умеренным выходом. Вода была удалена азеотропная дистилляция сдвинуть равновесие вправо.

Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Применение [ править | править код ]
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Хранение этиленгликоля
Этиленгликоль токсичен и это действие зависит от ряда обстоятельств, таких, как индивидуальная чувствительность организма, количества вещества, попавшего в организм, состояния нервной системы и др.
Этиленгликоль хранится в не отапливаемых складских помещениях, в герметичных стальных и алюминиевых емкостях с антикоррозионным покрытием внутренних поверхностей. Емкости хранятся в вертикальном положении. Срок хранения в соответствующей таре составляет 5 лет со дня изготовления с возможностью продления срока при условии соответствующих показателей качества.
Источник
Неотложная помощь при остром отравлении этиленгликолем
Если нет возможности доставить пострадавшего к врачу, а текущее состояние отравленного продолжает ухудшаться, то необходимо сделать следующее:
- Вызвать рвоту, промыть желудок водой и сделать сифонную клизму;
- Необходимо давать пострадавшему щелочное питьё – подойдёт 5% раствор пищевой соды, например. Если есть Боржоми – очень хорошо. Необходимо вместе с питьём давать активированный уголь (или любой другой сорбент), из расчёта 1 таблетка на 10 кг массы тела;
- При возможности – нужно сразу поставить капельницу с глюкозой (если рядом есть медработник или вы умеете это делать);
Активированный уголь может впитать часть вредных веществ
Тело желательно согревать грелками, пострадавший должен (до приезда «скорой») находится в покое.
Смысл данной терапии состоит в том, что этиловый спирт замещает собой этиленгликоль в химических реакциях, что способствует быстрому выведению этой ядовитой субстанции из организма.
Всё время после отравления пациент должен много пить. Для ускорения пассажа жидкости назначаются диуретики.
Этиловый спирт — антидот к этиленгликолю
Сразу после проведения диагностики, таких больных отправляют на гемодиализ. Эта процедура позволяет спасти почки, удаляя этиленгликоль и его метаболиты из крови. Всё время, в течении которого производится гемодиализ уровень этанола в крови поддерживается на высоком уровне.
Гемодиализ при отравлении этиленгликолем является абсолютно необходимой процедурой, улучшающей состояние нервной системы, почек, сердца и лёгких.
«>
Токсичность
Этиленгликоль умеренно токсичен, при пероральном LDLo = 786 мг / кг для человека. Основная опасность заключается в его сладком вкусе, который может привлечь детей и животных. При проглатывании этиленгликоль окисляется до гликолевая кислота, который, в свою очередь, окисляется до Щавелевая кислота, который токсичен. Он и его токсичные побочные продукты сначала влияют на Центральная нервная системазатем сердце и, наконец, почки. При отсутствии лечения проглатывание в достаточном количестве смертельно. Только в США ежегодно регистрируется несколько смертей.
Антифризы для автомобилей, содержащие пропиленгликоль вместо этиленгликоля доступны. Их обычно считают более безопасными, так как пропиленгликоль не такой вкусный. и преобразуется в теле в молочная кислота, нормальный продукт обмена веществ и физических упражнений.
Австралия, Великобритания и семнадцать штатов США (по состоянию на 2012 г.) требуют добавления горького вкуса (денатония бензоат) в антифриз. В декабре 2012 года производители антифризов США добровольно согласились добавлять горький ароматизатор во все антифризы, продаваемые на потребительском рынке США.
Экологические последствия
Этиленгликоль — это крупносерийная химия; он распадается на воздухе примерно через 10 дней, а в воде или почве — через несколько недель. Он попадает в окружающую среду за счет рассеивания продуктов, содержащих этиленгликоль, особенно в аэропортах, где он используется в противообледенительный агенты для взлетно-посадочных полос и самолетов. В то время как пролонгированные низкие дозы этиленгликоля не проявляют токсичности, в дозах, близких к летальным (≥ 1000 мг / кг в день), этиленгликоль действует как тератоген. «Основываясь на довольно обширной базе данных, он вызывает изменения скелета и пороки развития у крыс и мышей при всех путях воздействия». Эта молекула наблюдалась в космосе.
Некоторые нюансы производства гликоля
В конце 1850-х годов химик из Франции Вюрц получил этиленгликоль из его диацетата, а чуть позже путем гидратации этиленоксида. Но в то время практического применения новое вещество нигде не нашло. Лишь в 1910-х годах его начали использовать при изготовлении взрывчатых соединений. Плотность гликоля, его иные физические свойства и дешевизна производства обусловили то, что им заменили глицерин, который применялся до этого.
Особые свойства 1,2-этандиола по достоинству оценили американцы. Именно они наладили в середине 1920-х его промышленное изготовление на специально построенном и оборудованном заводе в Западной Вирджинии. В последующие годы гликоль использовали почти все известные на то время компании, занимавшиеся производством динамита. В настоящее время интересующее нас соединение, которое имеет третий класс опасности, изготавливается по технологии гидратации окиси этилена. Существует два варианта его производства:
- с участием ортофосфорной либо серной кислоты (до 0,5 процентов) при температуре от 50 до 100 °С и давлении в одну атмосферу;
- при температуре около 200 °С и давлении в десять атмосфер.
В результате реакции гидратации образуется до 90 процентов чистого 1,2-диоксиэтана, некоторое количество полимергомологов и триэтиленгликоля. Второе соединение добавляют в гидравлические и тормозные жидкости, оно применяется в промышленных системах охлаждения воздуха, из него делают препараты для дезинфекции, а также пластификаторы.
Цены на растворы этиленгликоля оптом
Мы производим по индивидуальному заказу растворы с любой концентрацией, равно любой температуры замерзания.ВНИМАНИЕ! В связи с колебанием рыночных цен на сырье, указанные на сайте цены на текущий момент могут быть не актуальны. Уточняйте цены у менеджеров по запросу
Цена не является публичной офертой. Указанная средняя стоимость в руб./кг носит информационный характер. Условия доставки товара обсуждайте с менеджером.
| Наименование товара | Температура кристаллизации | Варианты фасовки | Вес нетто, кг | Кол-во единиц в паллете | Цена до 5т, руб./кг (с НДС) | Цена от 5т до 10т, руб./кг (с НДС) | Цена от 10т, руб./кг (с НДС) | Наличие | Оформить заказ |
| 65% раствор этиленгликоля | -60°C | Налив | 1 | 1 | 61,20 | 60,60 | 60,00 | В наличии | |
| Бочка | 220 | 4 | 79,15 | 71,80 | 66,65 | В наличии | |||
| Еврокуб | 1085 | 1 | 82,90 | 74,30 | 68,95 | В наличии | |||
| 60% раствор этиленгликоля | -50°C | Налив | 1 | 1 | 54,40 | 53,85 | 53,30 | В наличии | |
| Бочка | 220 | 4 | 72,95 | 66,15 | 61,40 | В наличии | |||
| Еврокуб | 1078 | 1 | 74,35 | 67,40 | 62,55 | В наличии | |||
| 54% раствор этиленгликоля | -42°C | Налив | 1 | 1 | 50,15 | 49,65 | 49,15 | В наличии | |
| Бочка | 220 | 4 | 66,00 | 59,80 | 55,50 | В наличии | |||
| Еврокуб | 1070 | 1 | 69,55 | 63,05 | 58,50 | В наличии | |||
| 50% раствор этиленгликоля | -35°C | Налив | 1 | 1 | 48,15 | 47,70 | 47,20 | В наличии | |
| Бочка | 220 | 4 | 63,85 | 57,85 | 53,70 | В наличии | |||
| Еврокуб | 1067 | 1 | 67,30 | 61,00 | 56,60 | В наличии | |||
| 40% раствор этиленгликоля | -25°C | Налив | 1 | 1 | 42,85 | 42,40 | 42,00 | В наличии | |
| Бочка | 220 | 4 | 55,50 | 50,30 | 46,65 | В наличии | |||
| Еврокуб | 1052 | 1 | 59,15 | 53,60 | 49,70 | В наличии | |||
| 36% раствор этиленгликоля | -20°C | Налив | 1 | 1 | 38,45 | 38,05 | 37,65 | В наличии | |
| Бочка | 220 | 4 | 52,30 | 47,35 | 43,90 | В наличии | |||
| Еврокуб | 1046 | 1 | 56,20 | 50,90 | 47,25 | В наличии |
Сфера применения
По статистике почти половина пропандиола применяется как сырье для получения ненасыщенных полиэфирных смол. Это возможно благодаря свойству гликоля вступать в химическую реакцию с ненасыщенными малеиновыми ангидридами и изофталевой кислотой. Продуктом реакции становится частично ненасыщенный сополимер, который в дальнейшем сшивается и образует термореактивную пластмассу. В результате реакции пропиленгликоля и оксида пропилена получают полимеры для производства полиуретана, олигомеры и другие органические соединения.
Пищевой пропиленгликоль (по международной классификации – Е1520) применяется как растворитель и консервант продуктов. Корма для животных, производство табачных изделий и жидкостей для парогенераторов, производство средств косметики и личной гигиены – еще несколько областей использования 1,2-пропандиола.
Одно из ключевых свойств гликоля – повышение и понижение температуры жидкостей – нашло применение при производстве противообледенительных жидкостей для самолетов, автомобильных антифризов, теплоносителей для инженерных систем и климатического оборудования. Низкая токсичность вещества позволяет использовать его в отопительных системах с открытым контуром, на объектах с повышенными требованиями к экологической безопасности.
Этиленгликоль – токсичный двухатомный спирт
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел);
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.
Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к смерти. При однократном употреблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.
Пары данного соединения менее токсичны. Так как этиленгликоль характеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Автор статьи: Anatoly Zolotkov
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.