Водно-гликолевый раствор
Содержание:
- Виды и особенности
- Физические свойства этилена (этена):
- Этилен (этен), формула, газ, характеристики:
- Применение гликолей в промышленности
- История открытий и производства
- Экологические последствия
- Влияние этиленгликоля на организм человека
- Способ применения Глюкозы и дозировка
- Меры безопасности [ править | править код ]
- Применение
- Что такое этиленгликоль
- Получение — этиленгликоль
- Очистка и осушение
- Токсичность
- Физические свойства
- Структура и свойства
Виды и особенности
Для обогрева загородных домов и дач устраивается автономная система отопления. Она состоит из нагревательного котла, соединённого с радиаторами отопления разветвлённой системой трубопроводов. Заливаемая в них незамерзающая жидкость выполняет роль теплоносителя. После нагревания в котле она поступает по трубам к радиаторам.
Незамерзающую жидкость принято называть антифризами. Их химический состав не позволяет им замерзать даже в самые сильные морозы. Антифризы предотвращают появление коррозии на внутренней поверхности труб и радиаторов и не образует на ней накипи. Выбор вида теплоносителя для заливки в отопительную систему от различных факторов, в числе которых климатические условия региона его использования.
Помимо антифриза, выполняющего роль теплоносителя, правила эксплуатации отопительной системы требуют её периодической промывки специальными жидкостями. Их состав содержит различные присадки.
Альтернативным вариантом таким промывочным жидкостям может служить водный раствор каустической соды. Заполняют им систему на 1-1,5 часа. Делают это для растворения содовым раствором скопившейся на внутренних поверхностях элементов отопительной системы накипи.
В продаже можно встретить антифризы с различными характеристиками. В качестве их основы могут использоваться:
Глицерин
Этиленгликоль
Пропиленгликоль
Все эти вещества имеют высокую степень агрессивности, поэтому производители добавляют в их состав различные присадки. Основной компонент антифриза определяет его свойства. Самую доступную стоимость имеют незамерзающие жидкости на основе этиленгликоля, но они и наиболее токсичные.
Незамерзающие жидкости на основе этиленгликоля нельзя применять для двухконтурных котлов. Попадание такого антифриза в систему водоснабжения может вызвать тяжёлое отравление. Жидкость закипает при температуре выше 110°С и может дать осадок. Он часто становится причиной выхода системы отопления из строя.
Менее опасны и вредны для организма человека антифризы на основе пропиленгликоля. Экологически безопасны незамерзающие жидкости, изготовленные на основе глицерина.
Антифризы этого вида хорошо защищают систему отопления от коррозии. Особенностью глицериновых незамерзающих жидкостей является то, что при переходе в твёрдое состояние они не увеличиваются в объёме.
Самая низкая температура замерзания и наиболее высокая точка кипения, а также теплопередающая способность у раствора бишофита. Очень часто в системы отопления в качестве теплоносителя используют растворы кальция, натрия и других минеральных солей. Их достоинством считается высокая коррозийная агрессивность.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
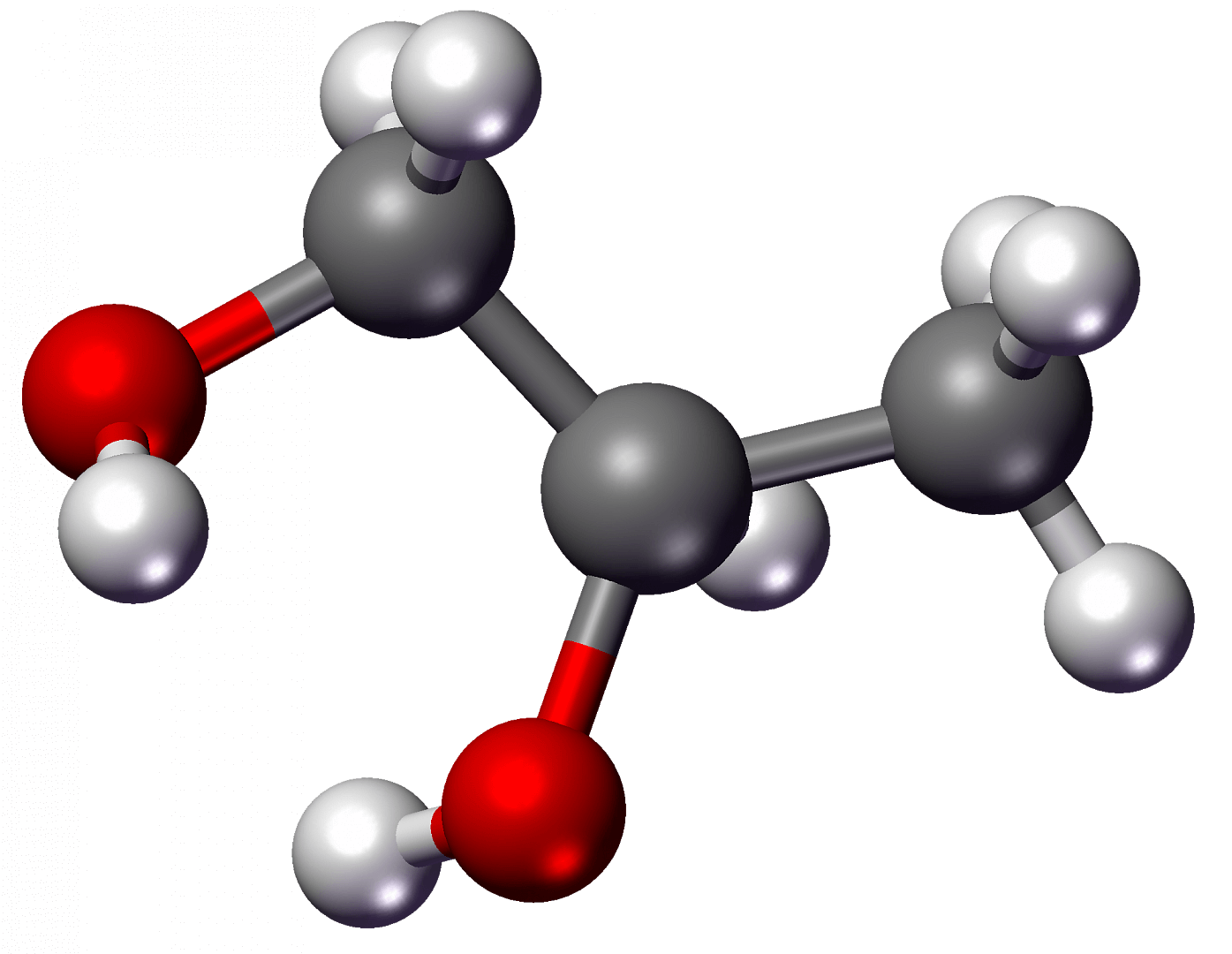
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Строение молекулы:
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде. Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Применение гликолей в промышленности
Концентрированный водный раствор гликоля обладает сильной коррозионной активностью. Для защиты элементов инженерных сетей в промышленности гликоли применяются только с пакетом антикоррозионных присадок. Без этого охладительный или отопительный контур оборудования загрязняется продуктами коррозии. Образующиеся внутри пробки ведут к засорам, ухудшению эксплуатационных характеристик и поломкам оборудования.
Самая распространенная концентрация гликоля в водном растворе, при использовании в качестве теплоносителя – 40 %. Испытания показали, что водный раствор двухатомного спирта с добавлением карбоксилатных ингибиторов коррозии сохраняет свои эксплуатационные свойства до 10 лет и более лет.
Использование водных растворов диолов с пакетом противокоррозионных присадок в качестве теплоносителя исключает появление паровых пробок в отопительной системе, уменьшает кавитацию, снижает риск эрозии металла трубок и радиатора. В комплексе это значительно увеличивает эксплуатационный ресурс оборудования.
Водные растворы гликолей с различной концентрацией используются промышленности:
- Машиностроении;
- Приборостроении;
- Добывающей промышленности (нефть, газ, горнодобывающая и т.д.);
- Химической;
- Пищевой.
В качестве теплоносителя обычно применяются растворы этиленгликоля (ЭГ, МЭГ), и пропиленгликоля (ПГ).
Вам могут быть интересны следующие товары
| Наименование | Цена за кг, руб. с НДС | Покупка |
| Раствор этиленгликоля | от 37,65 руб./кг | |
| Раствор пропиленгликоля | от 37,65 руб./кг | |
| Котловая вода | от 33,25 руб./кг |
Вам могут быть интересны услуги
| Наименование | Заказ |
| Промывка инженерных и климатических систем | |
| Замена теплоносителя | |
| Промывка систем холодоснабжения | |
| Мониторинг |
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида.
Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ.
В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Экологические последствия
Этиленгликоль — это крупносерийная химия; он распадается на воздухе примерно через 10 дней, а в воде или почве — через несколько недель. Он попадает в окружающую среду за счет рассеивания продуктов, содержащих этиленгликоль, особенно в аэропортах, где он используется в противообледенительный агенты для взлетно-посадочных полос и самолетов. В то время как пролонгированные низкие дозы этиленгликоля не проявляют токсичности, в дозах, близких к летальным (≥ 1000 мг / кг в день), этиленгликоль действует как тератоген. «Основываясь на довольно обширной базе данных, он вызывает изменения скелета и пороки развития у крыс и мышей при всех путях воздействия». Эта молекула наблюдалась в космосе.
Влияние этиленгликоля на организм человека
Этот двухатомный спирт в основном входит в состав продуктов для ухода за помещениями, машинами и техникой. По своим физическим свойствам он отличается от привычного спирта маслянистой консистенцией и отсутствием запаха, поэтому его сложно перепутать с этанолом или изопропанолом, которые нередко употребляют внутрь. Возможны ли отравления этиленгликолем у людей? — да, несмотря на явные различия с другими спиртами отравиться им можно.
В каких случаях происходит отравление?
- Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно.
- Гликоль попадает внутрь при постоянной работе с ним, к примеру, если человек трудится на химическом производстве продуктов, содержащих этиленгликоль.
- Отравиться можно при случайном употреблении его внутрь.
- Так как это химическое соединение используется для обработки машин, то в группе риска находятся люди, регулярно сталкивающиеся с ним по долгу службы.
Этиленгликоль токсичен и относится к веществам третьего класса опасности. После поступления в организм человека он очень быстро всасывается в желудке и верхнем отделе тонкого кишечника. Не более 30% его выделяется в неизменном состоянии почками или в виде солей. Остальная же часть поступает в печень, где и происходит его преобразование.
В печени он разлагается до конечных продуктов:
- гликолевой кислоты;
- муравьиной и щавелевой кислоты;
- гликолевого альдегида.
Как влияет этиленгликоль на организм человека? Все эти конечные продукты распада действуют на кислотно-щелочное равновесие, что постепенно приводит к некрозу клеток головного мозга и почечной ткани. В организме развивается ацидоз или увеличение кислотности. Смертельная доза для человека составляет всего 100–150 мл. Но даже попадание небольшого количества этиленгликоля приведёт к развитию отравления, хотя и в лёгкой степени.
Способ применения Глюкозы и дозировка
Глюкозу взрослым вводят внутривенно капельно:
- Раствор Глюкозы 5% – до 2 литров в день со скоростью 7 мл в минуту;
- 10% – до 1 литра со скоростью 3 мл в минуту;
- 20% – 500 мл со скоростью 2 мл в минуту;
- 40% – 250 мл со скоростью 1,5 мл в минуту.
По инструкции, раствор Глюкозы 5% и 10% можно также вводить внутривенно струйно.
Для максимального усвоения больших доз активного компонента (декстрозы) рекомендуется вместе с ней вводить инсулин. На фоне сахарного диабета раствор следует вводить, контролируя уровень глюкозы в моче и крови.
Для парентерального питания детям вместе с аминокислотами и жирами в первый день вводят раствор Глюкозы 5% и 10% из расчета 6 г декстрозы на 1 кг массы тела в день. При этом следует контролировать допустимый суточный объем вводимой жидкости:
- Для детей с весом 2-10 кг – 100-160 мл на 1 кг;
- С весом 10-40 кг – 50-100 мл на 1 кг.
Во время проводимого лечения необходимо постоянно контролировать уровень глюкозы.
Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):
Химические свойства многоатомных спиртов
1. С активными металлами:
2. С гидроксидом меди( II ) – качественная реакция!
1. С галогенводородными кислотами
Т ринитроглицерин — основа динамита
- Этиленгликольпроизводства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканейи в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА
1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной .
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Получение — этиленгликоль
|
Технологическая схема синтеза этиленгликоля. |
В качестве примера рассмотрим технологическую схему получения этиленгликоля ( рис. 84), которая применима и для синтеза пропиленгликоля. Процесс проводят без катализаторов при 160 — 200 С под давлением, обеспечивающим сохранение смеси в жидком состоянии. Исходную шихту готовят из свежего и оборотного водного конденсата и этиленоксида, причем концентрация оксида составляет 12 — 14 %, что соответствует примерно 15-кратному мольному избытку воды по отношению к а-оксиду.
Однако по сравнению с обычным способом получения этиленгликоля через оксид этилена такой метод является слишком многостадийным и не имеет каких-либо преимуществ.
Однако по сравнению с обычным способом получения этиленгликоля через окись этилена такой метод является слишком многостадийным и не имеет каких-либо преимуществ.
В качестве примера рассмотрим технологическую схему получения этиленгликоля ( рис. 86), которая применима и для синтеза пропиленгликоля. Процесс проводят без катализаторов при 160 — 200 С под давлением, обеспечивающим сохранение смеси в жидком состоянии.
Однако по сравнению с обычным способом получения этиленгликоля через оксид этилена такой метод является слишком многостадийным и не имеет каких-либо преимуществ.
Дополнительные данные к окончательному отчету по работе Получение этиленгликоля из дихлорэтана, Отч.
Преимуществом такого протекания процесса является исключение стадии получения этиленгликоля из окиси этилена и отсутствие выделения в реакции этерификации низкомолекулярного продукта — воды.
Щелочной гидролиз низкомолекулярных хлоргидринов ранее широко применялся для получения этиленгликоля, этилен — и про-пиленоксида.
Этиленоксид применяется во многих промышленных синтезах: для получения этиленгликоля и различных полимеров.
Техническое оформление процессов получения пропиленгликоля и диэтилен-гликоля аналогично схеме получения этиленгликоля.
Из всего количества выработанной окиси этилена 64 % использовано для получения Этиленгликоля, 11 % в производстве гликолевых и полигли-колевых эфиров, 10 % для получения моющих и вспомогательных продуктов, 8 % для получения этаноламина, 5 % в производстве акрилонитрила и 2 % для различных других целей.
|
Потребление окиси этилена отдельными отраслями промышленности США в 1954 г. |
Наиболее важной областью применения окиси этилена является использование ее для получения этиленгликоля.
Из всего количества выработанной окиси этилена 64 % использовано для получения этиленгликоля, 11 % в производстве гликолевых и полигли-колевых эфиров, 10 % для получения моющих и вспомогательных продуктов, 8 % для получения этаноламина, 5 % в производстве акрилонитрила и 2 % для различных других целей.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Параметры эксплуатации этиленгликоля
Этиленгликоль заливают в алюминиевые бочки или в бочки из коррозионно-стойкой стали. По согласованию с потребителем этиленгликоль допускается заливать в стальные неоцинкованные бочки.
Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а так же наливом в ж/д цистернах (по согласованию с потребителем — в специально выделенных ж/д цистернах).
Этиленгликоль хранят в бочках в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках их углеродистой стали.
Родственные материалы этиленгликоля
Весьма близкими к этиленгликолю по свойствам являются диэтиленгликоль, триэтиленгликоль и глицерин, которые так же являются густыми прозрачными жидкостями, легко смешивающимися с водой, спиртом, ацетоном и некоторыми другими растворителями, причем глицерин является безвредным веществом. Диэтиленгликоль широко используется как растворитель смол, масел, нитроцеллюлозы и также в качестве основы антифризов.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали.Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Физико-химические показатели Этиленгликоля (Моноэтиленгликоля, МЭГ)
| # п/п |
Наименование показателя |
Норма | |
| Высший сорт ОКП 24 2212 0120 |
1-й сорт ОКП 24 2212 0130 |
||
| 1 | Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| 2 | Массовая доля диэтиленгликоля, %, не более |
0,05 (0,10) |
1,0 |
| 3 | Цвет в единицах Хазена, не более в обычном состоянии после кипячения с соляной кислотой |
5 20 |
20 Не нормируется |
| 4 | Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| 5 | Массовая доля железа (Fе), %, не более | 0,00001 | 0,0005 |
| 6 | Массовая доля воды, %, не более | 0,1 | 0,5 |
| 7 | Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 (0,001) |
0,005 |
| 8 | Показатель преломления при 20оС | 1,431 — 1,432 | 1,430 — 1,432 |
| 9 | Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 275 350 |
75 |
Не нормируется То же То же |
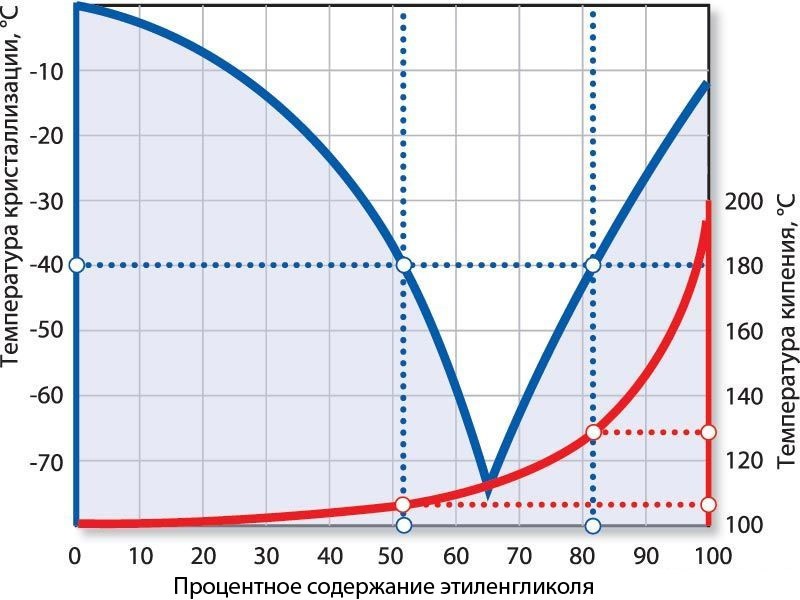
Температура замерзания водного раствора зависит от массовой доли
следующим образом:
| Массовая доля этиленгликоля (%) в водном растворе | Температура замерзания, ° C |
| 10 | -4 |
| 15 | -5 |
| 20 | -9 |
| 25 | -12 |
| 30 | -14 |
| 40 | -22 |
| 50 | -35 |
| 60 | -49 |
Токсичность
Этиленгликоль умеренно токсичен, при пероральном LDLo = 786 мг / кг для человека. Основная опасность заключается в его сладком вкусе, который может привлечь детей и животных. При проглатывании этиленгликоль окисляется до гликолевая кислота, который, в свою очередь, окисляется до Щавелевая кислота, который токсичен. Он и его токсичные побочные продукты сначала влияют на Центральная нервная системазатем сердце и, наконец, почки. При отсутствии лечения проглатывание в достаточном количестве смертельно. Только в США ежегодно регистрируется несколько смертей.
Антифризы для автомобилей, содержащие пропиленгликоль вместо этиленгликоля доступны. Их обычно считают более безопасными, так как пропиленгликоль не такой вкусный. и преобразуется в теле в молочная кислота, нормальный продукт обмена веществ и физических упражнений.
Австралия, Великобритания и семнадцать штатов США (по состоянию на 2012 г.) требуют добавления горького вкуса (денатония бензоат) в антифриз. В декабре 2012 года производители антифризов США добровольно согласились добавлять горький ароматизатор во все антифризы, продаваемые на потребительском рынке США.
Физические свойства
Окись этилена — бесцветный газ (при 25 °C) или подвижная жидкость (при 0 °C) с характерным эфирным сладковатым запахом, ощутимым при концентрации в воздухе свыше 500 частей на миллион. Хорошо растворима в воде, спирте, эфире и многих других органических растворителях. Температура кипения: 10,7 °C; температура плавления: −111,3 °C; плотность жидкой окиси этилена при температуре 10 °C относительно воды при той же температуре: 0,8824.
Основные термодинамические характеристики:
- стандартная молярная теплоёмкость вещества, Сop = 48,19 Дж/(моль·К);
- стандартная энтальпия образования, ΔHo298 = −51,037 кДж/моль;
- стандартная энтропия, So298 = 243,4 Дж/(моль·К);
- стандартная энергия Гиббса образования, ΔGo298 = −11,68 кДж/моль;
- теплота сгорания, ΔHoсгор. = −1306 кДж/моль.
Некоторые физические константы окиси этилена:
- Поверхностное натяжение в жидком состоянии на границе с собственным паром:
-
-
T, °C σ, мДж/м² −50,1 35,8 −0,1 27,6
-
- Температура кипения при давлении пара выше 101,3 кПа:
-
-
P, МПа P, атм T, °C 0,507 5 57,7 1,013 10 83,6 2,027 20 114,0
-
- Вязкость:
-
-
T, °C η, 10−3 Па·с −49,8 0,577 −38,2 0,488 −21,0 0,394 0,0 0,320
-
- Уравнение зависимости давления пара в интервале от −91 до 10,5 °C:
- lg(p ) = 6,251 − 1115,1 / (244,14 + t ).
- Дипольный момент при температуре 17—176 °C:
- 6,26⋅10−30 Кл·м (1,89 Д).
Физические свойства жидкой окиси этилена в температурном диапазоне от −40 до 195,8 °C:
| Температура,°C | Давление пара,кПа | Энтальпия жидкости,Дж/г | Энтальпия испарения,Дж/г | Плотность,кг/л | Теплоёмкость,Дж/(кг·К) | Теплопроводность,Вт/(м·К) |
|---|---|---|---|---|---|---|
| −40 | 8,35 | 628,6 | 0,9488 | 1878 | 0,20 | |
| −20 | 25,73 | 38,8 | 605,4 | 0,9232 | 1912 | 0,18 |
| 65,82 | 77,3 | 581,7 | 0,8969 | 1954 | 0,16 | |
| +20 | 145,8 | 115,3 | 557,3 | 0,8697 | 2008 | 0,15 |
| +40 | 288,4 | 153,2 | 532,1 | 0,8413 | 2092 | 0,14 |
| +60 | 521,2 | 191,8 | 505,7 | 0,8108 | 2247 | 0,14 |
| +80 | 875,4 | 232,6 | 477,4 | 0,7794 | 2426 | 0,14 |
| +100 | 1385,4 | 277,8 | 445,5 | 0,7443 | 2782 | 0,13 |
| +120 | 2088 | 330,4 | 407,5 | 0,7052 | 3293 | н/д |
| +140 | 3020 | 393,5 | 359,4 | 0,6609 | 4225 | н/д |
| +160 | 4224 | 469,2 | 297,1 | 0,608 | н/д | н/д |
| +180 | 5741 | 551,2 | 222,5 | 0,533 | н/д | н/д |
| +195,8 | 7191 | н/д | н/д | н/д | н/д | н/д |
Физические свойства паров окиси этилена в температурном диапазоне от 298 до 800 К:
| Температура, К | Энтропия, Дж/(моль·К) | Теплота образования, кДж/моль | Свободная энергия образования, кДж/моль | Вязкость, Па·с | Теплопроводность, Вт/(м·К) | Теплоёмкость, Дж/(моль·К) |
|---|---|---|---|---|---|---|
| 298 | 242,4 | −52,63 | −13,10 | н/д | н/д | 48,28 |
| 300 | 242,8 | −52,72 | −12,84 | 9,0 | 0,012 | 48,53 |
| 400 | 258,7 | −56,53 | 1,05 | 13,5 | 0,025 | 61,71 |
| 500 | 274,0 | −59,62 | 15,82 | 15,4 | 0,038 | 75,44 |
| 600 | 288,8 | −62,13 | 31,13 | 18,2 | 0,056 | 86,27 |
| 700 | 302,8 | −64,10 | 46,86 | 20,9 | 0,075 | 95,31 |
| 800 | 316,0 | −65,61 | 62,80 | н/д | 0,090 | 102,9 |
Структура и свойства
Орбитальное описание связи между этиленом и переходным металлом.
Этот углеводород имеет четыре водород атомы привязанный к паре углерод атомы, которые связаны между собой двойная связь. Все шесть атомов этилена являются копланарный. H-C-H угол составляет 117,4 °, что близко к 120 ° для идеального sp² гибридизированный углерод. Молекула также относительно слаба: вращение вокруг связи C-C — это процесс с очень низкой энергией, который требует разрыва π-связи путем подачи тепла при 50 ° C.
Π-связь в молекуле этилена отвечает за ее полезную реакционную способность. Двойная связь — это область высоких электронная плотность, поэтому он уязвим для атак электрофилы. Многие реакции этилена катализируются переходными металлами, которые временно связываются с этиленом, используя как π-, так и π * -орбитали.
Как простая молекула, этилен спектроскопически прост. Его УФ-видимый спектр до сих пор используется в качестве проверки теоретических методов.